0
发表咨询在线!

摘 要:应用研制的辉光放电低温等离子体杀菌设备,以大肠杆菌、志贺氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、黄曲霉菌、白色念珠菌6 种微生物为实验菌株,探讨辉光放电低温等离子体杀菌技术对不同微生物的杀菌动力学;应用扫描电镜、透射电镜、DNA电泳、光谱分析等技术,探讨辉光放电低温等离子体的杀菌机制。结果表明:辉光放电低温等离子体杀菌技术对大肠杆菌、志贺氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、黄曲霉菌、白色念珠菌6 种微生物的有效杀灭时间分别为2、1.5、3、4、10、10 min。依据杀菌动力学曲线,可以将 6 种微生物准确分为革兰氏阴性细菌、革兰氏阳性细菌和真菌3 类,这可能与微生物的细胞壁结构有关;辉光放电低温等离子体可能是通过带电的高能粒子对细菌的细胞壁造成破坏,进而杀死细菌。该研究为辉光放电低温等离子体技术广泛用于微生物杀菌提供了重要的方法依据。
关键词:低温等离子体;辉光放电;杀菌;动力学;机制
致病菌是引起人类疾病的重要因素之一,对人类健康造成极大的危害,也是食品安全的重大隐患。鉴于致病菌对食品安全及人类健康的巨大威胁,对它们的有效杀灭非常重要。目前常用的食品灭菌技术主要有加热灭菌、辐照灭菌和化学杀菌等。加热灭菌所需的高温通常会破坏食品原有的色、香、味、形,对食品品质和营养的影响很大,而且加热灭菌能耗也较高,限制了其应用范围。辐照灭菌是一种新型有效的杀菌方法,其应用越来越广泛,但辐照食品是否对人类健康有危害的困惑目前仍未明晰,像欧盟等一些国家对辐照食品仍持相当严格和谨慎的态度,另外像日本核泄漏、河南杞县“钴 60事件”等放射物质泄漏事件也引起了人们对辐照技术使用的戒备心理。化学杀菌的化学消毒剂一方面会影响食品原有的色、香、味,最重要的是其化学副产物直接威胁着人类健康。鉴于上述问题,开发清洁、安全、高效、环保的杀菌新技术显得尤为重要。
等离子体是气体在受到外界高能量(高温、强电磁场、辐射等)作用时电离产生的一种高度电离的气体,其中的正负电荷总数相等,呈电中性,因而称为等离子体。低温等离子体是相对于其体系中的高温电子而言,即在低温等离子体系中,电子的温度很高,可达上千乃至上万摄氏度,而其中的离子及分子的温度与常温相当,所以整个体系在宏观上表现为常温[1-3]。但其体系中的高能电子及各种激发态离子都具有很高的活性,可以实现对微生物的快速杀灭[4-7]。低温等离子体杀菌技术较传统杀菌技术具有低温、快速、绿色、环保等优点。特别在食品杀菌中的应用方面,更具有无残留、营养成分无破坏等无可比拟的优点。目前,关于低温等离子体技术研究的重点主要体现在杀菌技术的开发及应用方面。但是关于低温等离子体杀菌技术对不同种类微生物的杀菌动力学研究鲜有报道。另外,关于低温等离子体的杀菌机理,有研究表明温度、紫外线、高压电场、带电粒子以及活性氧(reactive oxygen species,ROS)都在低温等离子体的灭菌过程中起主要作用[8-12]。但迄今为止还没有一个比较圆满的答案。Montie等[9]对常压低温等离子体杀菌提出了3 种假设:氢氧活性基团引起脂质的过氧化而失活、氨基酸氧化导致蛋白质氧化引起的微生物失活以及氧化活性基团引起的DNA氧化失活。石兴民等[13-14] 研究表明带电粒子和ROS在低温等离子体杀菌中起主要作用,而高压电场的作用可以忽略。顾春英等[15]研究发现,等离子体臭氧对大肠杆菌的杀灭机理主要是作用于细胞壁和细胞膜。有研究表明,在大气压下的等离子体中,紫外光子产生又重新复合,难以到达处理的表面,因此紫外线并不对灭菌起作用[16-18]。低温等离子体杀菌机理的多种假说可能是由于低温等离子体种类的不同所致,这尚需针对某一类型等离子体单独进行研究。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli,E. coli)ATCC 10536、金黄色葡萄球菌(Staphylococcus aureus,S. aureus) ATCC 12600、单核细胞增生李斯特氏菌(Listeria monocytogenes,L. monocytogenes)ATCC 19114、宋内氏志贺氏菌(Shigella sonnei,S. sonnei)ATCC 25931 美国模式培养物集存库;黄曲霉菌(Aspergillus flavus, A. flavus)CGMCC 3.6434、白色念珠菌(Candida albicans,C. albicans)CGMCC 2.4159 中国普通微生物菌种保藏管理中心。
细菌从-70 ℃接种到营养肉汤中,36.5 ℃培养 18~24 h,备用。A. flavus CGMCC 3.6434划线接种于孟加拉红琼脂平板,28 ℃培养5 d,C. albicans CGMCC 2.4159接种于YPD培养基,28 ℃培养18~24 h,备用。
三羟甲基氨基甲烷、乙二胺四乙酸 美国Sigma公司;细菌基因组DNA提取试剂盒 天根生物技术有限公司;计数琼脂、YPD培养基、孟加拉红琼脂培养基、营养肉汤 北京陆桥技术有限责任公司;琼脂糖、磷酸氢二钠、磷酸二氢钠、氯化钠等试剂均为国产分析纯。
1.2 仪器与设备
辉光放电低温等离子体杀菌设备(自制,交流输出,0~10 kV,峰值功率120 W,工作频率30~40 kHz,通过在电路中加入限流电阻维持辉光放电)。
核酸蛋白分析仪、核酸电泳仪 美国Bio-Rad公司;扫描电镜、透射电镜 日本JEOL公司;Tektronix TDS 1002示波器 美国泰克公司;CR22GⅢ离心机日本日立公司;恒温恒湿培养箱、干燥箱 美国3M公司。
1.3 方法
1.3.1 杀菌动力学曲线的绘制
1.3.1.1 菌悬液的制备
分别吸取E. coli、S. aureus、L. monocytogenes、 S. sonnei肉汤培养液1 mL于1.5 mL离心管中,无菌生理盐水充分洗涤后,用核酸蛋白分析仪测定细胞浓度,并调整细胞浓度至107 CFU/mL。
用接种环从孟加拉红琼脂平板上刮取A. flavus菌丝,转入盛有1 mL无菌生理盐水的1.5 mL离心管中,用移液器充分吹打。吸取C. albicans YPD培养液1 mL于1.5 mL 离心管中,无菌生理盐水充分洗涤并调整细胞浓度至 106 CFU/mL。
1.3.1.2 涂片
吸取E. coli菌悬液10 μL于一无菌载玻片上,均匀涂开。设置1、1.5、2、3、4 min 5 个杀菌处理时间,每个处理时间分别制作6 个涂片,3 个用于灭菌,3 个用作对照。S. sonnei处理方法同E. coli。
S. aureus、L. monocytogenes涂片制备方法同E. coli。设置1、2、2.5、3、4 min 5 个杀菌处理时间,涂片处理方法同E. coli。
A. flavus、C. albicans涂片制备方法同E. coli。设置 5、8、10、12、15 min 5 个杀菌处理时间,涂片处理方法同E. coli。
1.3.1.3 杀菌
打开气瓶阀门,待放电气体氩气充满整个气体管路并将灭菌腔室中的空气排净,接通高压电源开始放电产生刷状低温等离子体射流。调整放电参数为:峰值电压 10 kV,工作频率30~40 kHz,峰值功率120 W,气体流量2 L/min,气压为常压,温度为室温。通过控制电压和气体流量保证放电装置持续放电产生等离子体。待低温等离子体充满整个灭菌腔室后,将各菌涂片置于灭菌室载物台上,载物台高度距离放电端口6 cm。对照于室温条件下放置同样时间。
1.3.1.4 灭菌效果检测
将处理组和对照组载玻片分别放于无菌培养皿中,加入20 mL无菌生理盐水将菌体全部洗下。然后吸取50 μL菌悬液涂布于营养琼脂平板上,36.5 ℃培养18~24 h,采用平板计数法计数存活的菌体数量。 A. flavus和C. albicans涂布于孟加拉红琼脂平板上,28 ℃ 培养5 d后进行计数。
1.3.2 辉光放电低温等离子体的杀菌机理实验
1.3.2.1 菌悬液的制备
制备E. coli和S. aureus 2 种菌悬液,方法同1.3.1.1节。最后调整菌液浓度至109 CFU/mL。
1.3.2.2 涂片
吸取E. coli、S. aureus菌悬液100 μL滴于无菌载玻片上,均匀涂开。每种菌分别制作3 个涂片。
1.3.2.3 杀菌
灭菌方法同1.3.2.3节。E. coli、S. aureus均处理4 min。
1.3.2.4 扫描电镜观察
将2 种菌经杀灭处理后的涂片各一片放于无菌培养皿中,加入1.5 mL 25 mL/L的戊二醛固定液(固定液内舍有0.1 mol/L磷酸盐缓冲液、40 g/L多聚甲醛)进行充分清洗,使细菌完全脱离载玻片。然后将菌悬液转入离心管中,4 ℃固定2 h。0.1 mol/L磷酸盐缓冲液浸洗30 min, 10 mL/L四氧化锇固定液4 ℃后固定2 h(固定液内含有 0.1 mol/L磷酸盐缓冲液),0.1 mol/L磷酸盐缓冲液浸洗 10 min,用30%乙醇10 min,50%乙醇10 min,70%乙醇10 min,90%乙醇10 min(2 次),100%乙醇10 min (3 次)梯度脱水,醋酸戊酯置换10 min,临界点干燥、喷金,扫描电镜下观察、拍照。未经杀灭处理的对照样本作同样处理。
1.3.2.5 透射电镜观察
将2 种菌经杀灭处理后的涂片各一片放于无菌培养皿中,加入1.5 mL 25 mL/L的戊二醛固定液清洗后,转入离心管中4 ℃固定2 h,后续处理同扫描电镜观察。乙醇梯度脱水后,环氧丙烷置换10 min,环氧树脂Epon 812浸透、包埋,聚合后作半超薄切片,美兰染色后光学显微镜下定位,进行超薄切片50~70 nm,醋酸铀、柠檬酸铅染色后,透射电镜下观察、拍照。未经杀灭处理的对照样本作同样处理。
1.3.2.6 DNA电泳
将2 种菌经杀灭处理后的涂片各一片放于无菌培养皿中,加入1.5 mL无菌生理盐水将细菌完全洗下,然后将菌悬液转入离心管中。
E. coli、S. aureus的DNA提取根据细菌总DNA提取试剂盒进行。取1 µL DNA样品,0.5%琼脂糖凝胶,120 V电泳 45 min。溴化乙锭染色,紫外凝胶成像系统观察检测 DNA的完整性。
1.3.2.7 光谱采集
控制辉光放电低温等离子体杀菌设备放电,放电设置及参数同1.3.1.3节。待低温等离子体充满整个灭菌腔室后,打开灭菌腔,将示波器探头对准并靠近等离子体喷射口采集等离子体激发光谱。
2 结果与分析
2.1 6 种微生物的杀菌动力学曲线
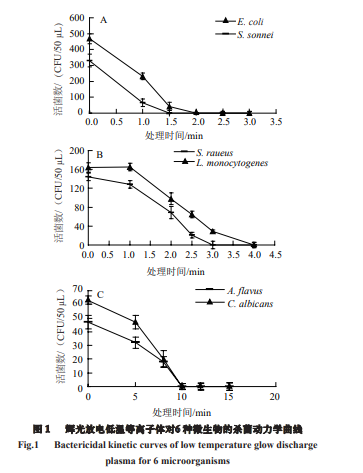
杀菌处理后的菌体细胞经培养后,记录平板上的活菌数,以杀菌时间为横坐标,活菌数为纵坐标,绘制6 种微生物的杀菌动力学曲线。由图1可知,研制的辉光放电低温等离子体杀菌设备可以对6 种微生物实现快速、有效杀灭。从杀菌速率上看,E. coli和S. sonnei最快被杀灭,在杀菌处理1 min时,细菌存活数已明显减少;从彻底杀灭微生物所需时间上看,E. coli和S. sonnei所需时间最短,分别只需要2 min和1.5 min,S. aureus需要3 min, L. monocytogenes需要4 min,A. flavus和C. albicans均需要10 min;从杀菌动力学曲线形状看,E. coli和S. sonnei 的曲线形状相似,S. aureus和L. monocytogenes相似, A. flavus和C. albicans属于一类,各种菌的杀菌动力学曲线将6 种微生物准确的分为革兰氏阴性细菌、革兰氏阳性细菌和真菌3 类。
2.2 辉光放电低温等离子体的杀菌机理
2.2.1 扫描电镜结果
经扫描电镜观察发现,在10 000和30 000 倍电镜视野下,等离子体处理前,玻片表面的细菌分布均匀,细菌表面光滑,边界完整,形态饱满(图2A、2C)。经辉光放电低温等离子体处理后,可见细菌胞壁和胞膜破裂,胞质外溢,细胞皱缩,失去原有形态,有的仅残存一些细胞碎片(图2B、2D)。
2.2.2 透射电镜结果
经透射电镜观察发现,正常的大肠杆菌呈杆状,金黄色葡萄球菌呈球形,细胞壁及细胞膜结构完整,细胞壁结构极明显,电子密度较高,胞浆内电子密度均一(图3A、3C)。经辉光放电低温等离子体处理后,细菌细胞壁和胞浆内电子密度都降低。有的菌体细胞壁及细胞膜断裂,核心溶解,菌体近似空壳(图3B、3D)。
2.2.3 核酸电泳结果
对细菌基因组DNA电泳结果显示,经辉光放电低温等离子体处理细菌的核酸和对照核酸大小一致,且带型完整,没有拖尾现象(图4)。初步推测辉光放电低温等离子体处理未对细菌的核酸造成明显破坏。
2.2.4 光谱分析
由图5可知,低温等离子体在700~1 000 nm波长范围内对氩气有较大激发,主要为可见光和近红外光线,在300~400 nm波长范围内有微弱激发,主要为紫外线,可能与灭菌腔体中的少量空气有关。由光谱分析结果可以说明低温等离子体激发氩气产生的几种射线不是导致细菌死亡的主要原因。
3 讨 论
在设备研制方面,由于大气压下的辉光放电极易向电弧放电转化,大气压下辉光放电等离子体的产生及维持非常困难。目前维持大气压下辉光放电的方法主要有 3 种,分别是串联电阻、介质阻挡、短脉冲驱动[19-20]。本实验通过在电路中加入限流电阻的形式来维持辉光放电,解决了大气压下的辉光放电问题,从而保证了放电等离子体的“低温”。
相关知识推荐:审稿人拒稿的原因
从6 种微生物的杀菌动力学曲线来看,各种菌的杀灭时间有所不同,分析原因可能与微生物的细胞壁结构有关。细胞壁越厚,击碎或是穿透细胞壁需要的时间越长。革兰氏阴性细菌细胞壁的厚度约为2 nm,革兰氏阳性细菌细胞壁厚度为15~18 nm[21],而真菌细胞壁的厚度则达到100~200 nm。细胞壁的厚度恰好与微生物的杀灭时间呈正相关。本实验提供了一个应用低温等离子体技术进行杀菌的新思路,即通过对各类微生物进行杀菌动力学研究,总结归纳出各类微生物的杀灭规律,便可得到针对大多数微生物的广谱灭菌参数。比如,若对一般的细菌进行杀菌,需要4~5 min即可;若对真菌进行杀菌,则需要10 min左右。这将为辉光放电低温等离子体杀菌技术广泛用于微生物杀菌提供重要的方法依据,从而有助于推动低温等离子体技术在杀菌领域特别是食品杀菌领域的推广应用。当然,微生物往往借助于各种 “寄主”生存。因此,在实际应用中,必须考虑微生物生存基质对杀菌效果的影响,这是低温等离子体杀菌技术需要重点研究和解决的问题。
低温等离子体灭菌机制包括等离子体物理和细胞分子生物学两个方面。从等离子体物理方面来讲,由于低温等离子体成分复杂,其中有杀菌作用的成分有带电粒子(离子和电子)、紫外线、ROS以及射线,这与放电气体和放电方式有关。故究竟哪种成分起主要作用,目前尚存在争议。从细胞分子生物学方面来讲,需要确定等离子体破坏微生物细胞的具体位点,比如细胞壁、细胞膜、细胞中的蛋白质、酶、亚细胞器以及DNA等都有可能是等离子体的作用靶点,而低温等离子体究竟破坏了微生物细胞内哪些组分而导致微生物死亡,目前也不十分清楚。本研究从等离子体物理和细胞分子生物学两方面探讨了辉光放电氩气低温等离子体对微生物的杀灭机制。对氩气等离子体的光谱分析可以说明低温等离子体激发氩气产生的几种射线不是导致细菌死亡的主要原因,这与Moisan等[22]的研究结论一致。张剑等[23]也证明了过氧化氢等离子体杀灭芽孢杆菌过程中,紫外线并不起主要作用。另外,核酸电泳结果说明低温等离子体并未造成菌体 DNA的明显断裂,也进一步说明紫外线并不是杀死细菌的主要原因。扫描电镜和透射电镜观察结果显示,低温等离子体明显破坏了细菌的外部结构(细胞壁和细胞膜),这与张灿等[24]的研究结果一致。因为本实验采用氩气作为放电气体,所以不存在ROS的氧化作用。因此,这可能是低温等离子体中的带电粒子的击穿作用所致。综上分析,初步得出氩气低温等离子体可能是通过带电的高能粒子对细菌的细胞壁造成破坏,进而杀死细菌的结论。至于低温等离子体是怎样破坏细菌的外部结构,比如是否破坏了细胞壁中肽聚糖结构,是否将蛋白质分解成小分子的多肽片段等,目前并不清楚,还需进一步研究。
辉光放电低温等离子体杀菌技术克服了热力、化学及辐照等方法中的不足,将具有较大的应用前景和研究价值。未来对该技术的研究重点应放在:1)加强低温等离子体的应用研究特别是在食品杀菌领域的应用研究; 2)研究低温等离子体杀菌技术与其他杀菌方法结合使用的效果,结合多种杀菌方法优势,开发新型杀菌设备; 3)继续深入研究各种低温等离子体的杀菌机理,为其在食品工业中的应用提供更多理论依据。——论文作者:李兆杰1 ,杨丽君1,*,刘小菁2 ,王 静1 ,刘玉敏1 ,李春喜1
参考文献:
[1] 马挺军, 史喜成, 贾唱喜. 低温等离子体在食品杀菌中的研究进展[J]. 农产品加工: 创新版, 2009(6): 8-11.
[2] 倪盈, 陈永昌, 王明连, 等. 低温等离子体杀菌的实验研究[J]. 环境工程学报, 2009, 3(11): 1951-1955.
[3] 李蕴. 低温等离子体灭菌新技术及在食品中的应用[J]. 华东科技: 学术版, 2012(12): 47.
[4] 石兴民, 张冠军, 袁育康, 等. 低温等离子体对细菌芽孢的灭活研究[J]. 南方医科大学学报, 2009, 29(10): 2033-2036.
[5] 刘筱娣, 杜宁, 彭磊, 等. 一种低温等离子体针对变形链球菌杀灭效果的研究[J]. 中国消毒学杂志, 2010, 27(4): 373-378.
[6] 林向阳, 黄彬红, 李雁晖, 等. 低温等离子体杀灭橙汁S. aureus的研究[J]. 中国农学通报, 2011, 27(5): 439-446.
[7] 郑自娜, 流云风, 于俊梅. 低温等离子体灭菌的应用[J]. 中华医院感染学杂志, 2009, 19(8): 945-946.
[8] LAROUSSI M. Nonthermal decontamination of biological media by atmospheric-pressure plasmas: review, analysis, and prospects[J]. IEEE Transactions on Plasma Science, 2002, 30(4): 1409-1415.
[9] MONTIE C T, KELLY-WINTENBERG K, REECE R J. An overview of research using the one atmosphere uniform glow discharge plasma (OAUGDP) for sterilization of surfaces and materials[J]. IEEE Transactions on Plasma Science, 2000, 28(1): 41-50.
[10] LARONSSI M, LEIPOLD F. Evaluation of the roles of reactive species, heat, and UV radiation in the inactivation of bacterial cells by air plasmas at atmospheric pressure[J]. International Journal of Mass Spectrometry, 2004, 233(1/3): 81-86.
[11] 刘红霞, 陈杰. 低温等离子体灭菌研究与应用进展[J]. 现代预防医学, 2009, 36(14): 2695-2698.
[12] 叶帼嫔, 张茜, 潘红, 等. 低温等离子体活性水对致病菌的作用[J]. 中国科学: 生命科学, 2013, 43(8): 679-684.
[13] 石兴民, 郝炳华, 袁育康, 等. 气体等离子体对细菌损伤作用的电镜观察[J]. 中国消毒学杂志, 2003, 20(4): 284-286.
[14] 石兴民, 张冠军, 袁育康, 等. 低温等离子体对白色念珠菌影响的电镜观察[J]. 西安交通大学学报: 医学版, 2009, 30(6): 775-776.
[15] 顾春英, 薛广波, 居喜娟. 等离子体臭氧对大肠杆菌的杀灭机理研究[J]. 现代预防医学, 2004, 31(1): 33-35.
[16] DENG X T, SHI J J, KONG M G. Physical mechanisms of inactivation of Bacillus subtilis spores using cold atmospheric plasmas[J]. IEEE Transactions on Plasma Science, 2006, 34(4): 1310-1316.
[17] LAROUASI M. Sterilization of contaminated matter with an atmospheric pressure plasma[J]. IEEE Transactions on Plasma Science, 1996, 24(3): 1188-1191.
[18] HERRMANN H W, HENINS I, PARK J, et al. Decontamination of chemical and biological warfare (CBW) agents using an atmospheric pressure plasma jet(APPJ)[J]. Physics of Plasma, 1999, 6(5): 2284-2289.
[19] 卢新培, 严萍, 任春生, 等. 大气压脉冲放电等离子体的研究现状与展望[J]. 中国科学: 物理学 力学 天文学, 2011, 41(7): 801-815.
[20] 潘利江, 刘文正, 张德金, 等. 大气压辉光放电向弧光放电的转化特性研究[J]. 电源技术, 2012, 36(6): 885-888.
[21] GAUN L F, BEGGS C B, GEORGHIOU G E. Bactericidal action of the reactive species produced by gas-discharge nonthermal plasma at atmospheric pressure: a review[J]. IEEE Transactions on Plasma Science, 2006, 34(4): 1257-1269.
[22] MOISAN M, BARBEAU J, CREVIER M C, et al. Plasma sterilization methods mechanisms[J]. Pure and Applied Chemistry, 2002, 74(3): 349-358.
[23] 张剑, 史绍毅, 朱亭亭. 过氧化氢扩散和等离子体放电对嗜热脂肪芽孢杀灭效果比较[J]. 中国消毒学杂志, 2014, 31(7): 677-682.
[24] 张灿, 刘文君, 张明露. 水中细菌的低温等离子体灭活效果[J]. 环境与健康杂志, 2013, 30(12): 1081-1083.
* 稍后学术顾问联系您