0
发表咨询在线!

摘要:提出一种结合显微镜和微流控芯片技术的红细胞多角度形态学分析方法,实现了红细胞的动态显微成像,用于红细胞多角度形态学的测量与分析。利用微流控芯片的缩/扩结构使红细胞在特定位置产生旋转或翻转;利用MATLAB对采集到的视频图像进行分帧处理,通过灰度调整、中值滤波、形态学处理、质心法、目标物识别、动态跟踪等算法处理后,实现对血细胞的有效识别与准确的分类、计数;对分类结果进行多角度形态学分析,并对不同形态红细胞进行最大直径的测量。通过对单细胞多帧关联图像的分析,验证方法的准确性;并利用红细胞多角度形态学分析方法,对糖尿病患者血液及正常人血液进行实验。结果表明,糖尿病患者红细胞相比于正常人红细胞,其平均最大直径及分布宽度均增大。微流控芯片结合图像处理的方法可以实现糖尿病患者与正常人红细胞高通量检测及多角度分析,为其他类型样本细胞多角度形态学测量提供新方法。
关键词:微流控芯片;动态显微成像;多角度形态学分析;红细胞分布宽度
0引言
红细胞(RedBloodCells,RBCs)也称红血球,是血液中数量最多的一种血细胞,具有携带氧气,输送二氧化碳,维持血流结构等诸多功能,并参与机体免疫调控的自我调节,在人体血液循环系统中发挥着重要作用[1-4]。通常情况下,成熟的红细胞呈双凹圆盘状[2],其表面积和体积之比较大,有利于进行气体交换和自身变形。如果红细胞形态异常,其形态及体积将发生改变,常见的异常红细胞形态有水滴形、球形、椭圆形、镰刀形、半月形等[5]。因此,红细胞形态的变化,某种意义上决定着人体的健康状况,是诊断很多疾病的重要指标之一。
传统的检测血液细胞的仪器大多基于Coulter原理,对细胞形态进行间接检测[6,7]。这种方法存在一定的缺陷,当检测交叉细胞时,其信号会产生叠加现象,通常对糖尿病患者红细胞粘连及血小板聚集现象产生误差。为了克服这一缺点,需要对细胞进行直接的形态学测量,医院里常用的方法是人工血涂片镜检法,此方法是血液细胞学检查的基本方法,可以通过显微镜对血细胞形态进行静态分析,对各种血液病的诊断有很大的价值[8,9]。但血片制备和染色不良,常使细胞鉴别发生困难,甚至导致错误结论,另外,此方法只能对异常细胞进行单一角度的检测,无法实现对大样本量、多角度的检测[10],不仅费时,而且效率和精度都很低。为了实现对大样本量的检测,微流控芯片在生物医学研究中显示出巨大潜力,以微流控技术为基础的图像细胞分析法开始流行起来。该方法成本低,不需要复杂的样品制备,而且能够提供细胞形态的可视化信息,实现了对大样本量的检测。
因此,本文通过显微镜结合微流控芯片的方法,提出了动态显微成像技术对红细胞多角度形态分析的方法。这种方法不仅可以实现对红细胞大样本量、高分辨率的检测,同时利用细胞跟踪技术,对红细胞进行准确识别,实现对红细胞多角度的形态学分析。
1动态显微成像原理
为了获取红细胞在特定位置不同角度的形态,需要设计特定的通道结构,并利用显微镜对红细胞在通道中的流动状态进行采集,通过动态图像处理方法对采集到的视频图像进行处理,进而实现对红细胞多角度形态学的分析。
1.1单细胞多角度形态学获取
红细胞在通道中流动时,发生的旋转或翻转是随机的、不确定的,另外,微流控芯片通道结构设计的不同,它的作用和效果也不尽相同[11-13]。为了使红细胞在特定位置旋转或翻转,得到其不同角度的形态,本文将微流控芯片通道结构设计成进样口多弯曲结构与成像区域凹凸结构相结合的整体通道结构。
由于细胞的聚集性与黏附性,细胞在流体中流动时,会产生聚集成一团的现象,使成像区域不能更好的观察细胞的形态学特征,造成细胞的误识别。为了减少细胞聚集,将成团细胞顺序排列,在成像区域能够呈现出一排排的单细胞,在进样口增加了多弯曲结构。另外,由于红细胞特殊的双凹圆盘结构,在流体中流动时,红细胞会出现随机的、多角度的倾斜、翻转、旋转等现象。为了解决红细胞随机旋转/翻转现象,本文将成像区域通道结构设计成缩/扩结构,有效改变了流道内速度分布情况,实现了细胞在特定位置的翻转/旋转,增加了红细胞的不同形态特征,从而实现对红细胞更准确的识别与分析。
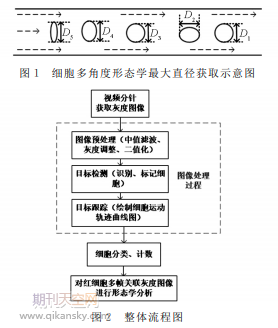
利用上述的通道结构,使红细胞在特定位置发生旋转或翻转,利用所呈现出来的不同角度的形态,对其形态参数进行测量。为了得到红细胞更为准确的最大直径,对单细胞的每一帧形态进行测量,计算其在此形态时的直径D,并将此单细胞所有形态下测得的直径(D1、D2、D3、…)进行比较,得到其最大直径。细胞多角度形态学最大直径获取示意图如图1所示。
1.2单细胞多帧图像关联分析
基于图像法的微流控芯片红细胞形态学分析通常涉及图像预处理、目标检测、目标跟踪三个主要部分[14-16]。整体流程图如图2所示。(1)图像预处理:将视频图像拆分为单帧灰度图像,采取分量法对原始图像进行灰度化,选择图像清晰且背景噪音小的范围作为研究对象。为了消除图像噪声,改善图像质量,本文采用3×3中值滤波对区域图像进行处理,最后,设置合适的阈值对灰度图像进行二值化处理[17-19]。(2)目标检测:在二值化图像中,对目标物进行检测与识别,利用质心法标记出所需要分析的目标物。首先,利用imclearborder函数将通道背景和在实验视野范围边缘的不完整的细胞进行清除,减小图像识别过程中的干扰;再利用连通域与面积判断的方法,将大于一定面积的细胞(红、白细胞)识别出来,剔除掉血小板,从而实现对目标物的检测与识别[17-18]。另外,需要对目标物体的横、纵坐标进行计算,标记其当前帧的质心位置。在此过程中,只对大于一定面积的目标物进行质心标记,并建立当前帧横、纵坐标数据集X1、Y1。(3)目标跟踪:在下一帧目标物的识别中,利用相同的检测方法,对当前帧目标物进行检测,并建立当前帧质心点坐标集X2、Y2。根据细胞位移特点,分别为当前帧每一个目标物进行前帧匹配,建立帧与帧之间的数据关联,并绘制其运动轨迹跟踪曲线,最后将当前帧目标质心点坐标集X2、Y2作为下一帧匹配的坐标集X1、Y1。(4)细胞分类、计数:对单细胞多帧跟踪结果进行分析,利用红、白细胞特征进行判断,进而实现对红、白细胞的分类、计数。最后,对分类结果的红细胞多帧关联的灰度图像进行形态学分析。
2实验与结果分析
2.1实验系统搭建
实验系统主要包括气路系统、微流控芯片、显微成像三个部分。气路系统主要由压力泵和调节阀组成,用来控制样品的进液速度,使全血细胞顺利的通过微流道,并可以在显微镜中清晰成像。用压力调节器调制进液样品的流速,其压力值大小可由压力表测量。微流控芯片结构方面,利用进样口多弯曲结构与成像区域凹凸结构相结合的整体通道结构设计芯片结构,并将缩/扩的凹凸结构作为成像区域,对血细胞成像效果进行验证。图3(a)为实验系统图,图3(b)为微流控芯片实物图,图3(c)为所涉及的微流道结构示意图,图3(d)为图3(c)虚线矩形框通道结构尺寸放大图及流体流动方向。
2.2单细胞多角度形态分析结果
为了验证本文基于动态显微成像对红细胞多角度形态学分析的准确性,利用人血细胞对红、白细胞进行形态学分析,并进行准确的分类与计数。取5μL的健康人血细胞加入1mL的PBS溶液中,充分混匀,将其作为实验的样本溶液。取少量溶液加入微流控芯片储液池中,通过调节压力泵调节阀控制样本溶液的流速,利用显微镜观察微流控芯片的成像区域,记录细胞通过通道的全过程。
基于以上图像处理方法对实验视频进行分析,对识别、跟踪到的细胞(红、白细胞),在视野范围内运动结束时,对其运动轨迹所有形态进行分析,利用红细胞的双圆环结构进行判断与区分。对88000帧图像进行处理,根据结果可知,当红细胞平行于通道时,图像处理可得到双圆环结构(红细胞特定结构),将单细胞跟踪到的所有形态进行分析,如有一帧为双圆环结构,可把它定义为红细胞,进而实现红、白细胞的区分。红细胞图像处理目标跟踪运动轨迹图如图4所示。同上述红细胞图像处理相同,图5为白细胞运动跟踪轨迹图。
根据1.2节所描述的处理步骤,对实验记录的视频进行处理。通过质心定位法建立数据坐标集,利用位移判断细胞上帧位置,建立帧与帧之间的相关联并绘制其运动轨迹跟踪曲线。计数结果显示,检测出红细胞数量为11270个,白细胞数量为11个。红、白细胞比例约为1000∶1,此方法可实现对红、白细胞的准确识别与计数。
2.3红细胞直径测量与统计分析
为了验证微流控结合显微镜对细胞多角度形态学分析的可行性,实验分别对糖尿病患者和正常人进行血液采集,并对两组血液进行相同浓度(200:1)配置,分析糖尿病患者红细胞与正常人红细胞形态大小的差异[20]。在进行直径标定前对细胞做旋转处理,即将细胞“摆正”,此时细胞质心的横、纵坐标处将会产生最大直径,如图6(a)所示。利用跟踪、识别对检测出的红细胞进行测量,分析每一个红细胞在视野范围内的不同形态,对其所有形态的最大直径进行检测,利用其质心坐标点的灰度二维曲线反值图的峰值宽度进行标定,对比得到其最大直径。
相关知识推荐:光学类期刊有哪些
对跟踪、识别出的红细胞进行测量,利用其质心位置的坐标点,绘制其灰度二维曲线图,如图6所示。对每一段视频随机选取十帧图像,经过对通道中实际尺寸已知的“十”字结构与其灰度二维曲线反值图的峰值宽度对比,得到红细胞直径灰度二维曲线反值图的峰值宽度与实际尺寸有固定比例。得到其灰度二维曲线反值图的峰值宽度与实际尺寸有固定比例,因此,在后续对红细胞不同形态的测量中,统一对其灰度曲线反值图的峰值宽度进行测量,并据此计算红细胞相对直径。
图像处理所计算出来的最大直径为像素点,为了避免视频拍摄过程中放大尺寸所造成的误差,利用通道中的固定尺寸参数进行比例换算,得到与实际情况相匹配的数值。正常红细胞与糖尿病患者红细胞最大直径分布如图7所示。
此实验统计中,正常人红细胞统计个数为10003个,平均最大直径约为7.886μm,标准差为0.761;糖尿病患者红细胞统计个数为10001个,平均最大直径约为10.026μm,标准差为1.837。统计结果在数值上均有增大,另外,统计图可以直观地看出,糖尿病患者具有更大的最大直径分布宽度,正常人红细胞最大直径分布宽度大约为5~9.5μm,糖尿病患者最大直径分布宽度大约为5.5~14μm。
3结论
显微镜结合微流控芯片技术,通过图像处理的方法,实现了对红、白细胞准确的分类、计数,通过对红细胞多角度形态学的分析,可准确测量红细胞的最大直径。为了验证该方法的可行性,分别对糖尿病患者和正常人红细胞进行实验和分析。正常人红细胞最大直径分布宽度大约为5~9.5μm,糖尿病患者约为5.5~14μm,糖尿病患者红细胞相比于正常红细胞最大直径会增大。实验结果测得,正常人红细胞平均最大直径约为7.886μm,糖尿病患者约为10.026μm,此方法可获得红细胞的最大直径;另外,糖尿病患者红细胞最大直径分布宽度比正常红细胞最大直径分布宽度更大。此方法实现了对血细胞大样本量、高分辨率的检测,可对红细胞多角度的不同形态进行准确识别,从而得到更准确的红细胞最大直径,为红细胞形态学分析提供方法。——论文作者:张朦,孟晓辰*,祝连庆
* 稍后学术顾问联系您