0
发表咨询在线!

摘要[目的]评定液相色谱-串联质谱法测定三文鱼中生物胺的不确定度。[方法]样品经过5%三氯乙酸提取、正己烷除脂、丹磺酰氯丙酮溶液衍生化后,液相色谱-串联质谱分析三文鱼中9种生物胺的含量,对方法相对标准不确定度、标准不确定度、扩展不确定度进行评估。[结果]色胺、β-苯乙胺、腐胺、尸胺、酪胺、组胺、精胺、亚精胺、去甲基肾上腺素的平均值分别为4.30、5.59、5.72、6.21、4.85、5.48、7.18、6.79、4.77mg/kg,扩展不确定度分别为0.46、0.56、0.48、0.54、0.42、0.50、0.64、0.55、0.41mg/kg(k=2)。[结论]标准储备液的配制、稀释以及标准曲线的线性拟合对不确定度的贡献值最大,建议选用精度好的量器,规范试验操作与前处理步骤。
关键词三文鱼;生物胺;液相色谱-串联质谱;不确定度
三文鱼是鲑科鱼,主要分布在大西洋、太平洋和欧洲北极的海岸[1]。三文鱼味道鲜美、营养丰富,不饱和脂肪酸(DHA、EPA、DPA)、蛋白质及维生素等含量丰富[2],有助于儿童智力发育、预防心血管疾病、降低癌症发病率等[3]。我国冰鲜三文鱼进口量逐年增加,三文鱼消费市场庞大[4]。但是在贮存运输过程中,三文鱼肌肉组织在微生物的作用下,极易发生蛋白质的分解、腐败变质,产生生物胺等有毒代谢物[5]。生物胺是极性或半极性化合物的氮化有机碱,根据其结构差异,可以分为3类:脂肪族生物胺(如腐胺、尸胺、亚精胺、精胺、胍基丁胺等[6-7])、芳香族生物胺(如酪胺、苯乙胺、苯甲胺等[8])、杂环胺(如组胺、色胺、5-羟色胺等[9])。
目前多种方法用于测定食品中的生物胺,如液相色谱-串联质谱[10]、高效液相色谱[11]、薄层色谱[12]、毛细管电泳[13]、气相色谱、气相色谱-串联质谱[14]、生物传感器[15]和ELISA[16]等。其中液相色谱-串联质谱法可对食品基质中的生物胺快速准确地定量分析。Nalazek-Rudnicka等[17]基于LC-MS/MS分析啤酒样品中测定生物胺的差异,方法的检出限和定量限分别是0.54~4.30、1.60~13.00ng/mL,该方法灵敏度高、特异性好。Ochi[18]通过反相液相色谱-串联质谱法测定咸鲭鱼中的腐胺、色胺、酪胺、组胺、β-苯乙胺、精胺、亚精胺、尸胺,8种分析物的平均回收率均在87%~118%,对生物胺快速准确进行定量分析。Gosetti等[19]建立了一种LC-MS/MS法同时测定尿液中16种生物胺,方法的检出限和定量限分别是0.3~6.6、1.0~21.9μg/L,平均回收率在72.9%~100.0%。
测量不确定度是说明测量结果质量的参数,用来表征合理、赋予被测量数值分散性[20],用于评价测量结果的可信性、有效性、科学性,代表实验室测量水平[21]。但是目前评定液相色谱-串联质谱法测定三文鱼中生物胺的不确定度的报道较少。余晓薇等[22]通过高效液相色谱法对鱼和虾中的组胺含量进行测定,建立组胺不确定度分析方法。胡礼渊等[23]对GB/T20768—2006《鱼和虾有毒生物胺的测定原理》进行不确定度评价,建立水产品中组胺含量不确定度评定方法。笔者根据《测量不确定度标示指南》和JJF1059.1—2012《测量不确定度评定与表示》,对液相色谱-串联质谱法测定三文鱼中生物胺的不确定度进行分析,以期为三文鱼中生物胺准确测定提供依据,也为实验室质量控制提供参考。
1材料与方法
1.1材料
1.1.1主要试剂。组胺(His)、精胺(Spe)、亚精胺(Spd)、尸胺(Cad)、腐胺(Put)、酪胺(Tyr)、色胺(Trp)均购自Bepure公司;β-苯乙胺(Phe)、去甲基肾上腺素(Ne)标准品购自上海吉尔生化有限公司;丹磺酰氯(LC-MS级)购自Sigma-Aldrich公司;乙腈(LC-MS级)、甲醇(HPLC级)、正己烷(HPLC级)均购自Thermofisher公司;高氯酸(分析纯)、三氯乙酸(分析纯)、氢氧化钠(分析纯)、碳酸氢钠(分析纯)、氨水(分析纯)、盐酸(分析纯)均购自国药集团化学试剂有限公司。
相关知识推荐:比较好中的农业科学期刊有哪些
1.1.2主要仪器。UPLC-XevoTQ-S超高效液相色谱串联三重四级杆质谱仪,购自美国Waters公司;ACQUITYUPLCHSST3(2.1mm×100mm,1.8μm)色谱柱,购自美国Waters公司;ZWF-110X30恒温水浴摇床,购自上海智城分析仪器制造有限公司;CF16RXⅡ离心机,购自日本HITACHI公司。
1.2方法
1.2.1标准溶液的配制。
1.2.1.1标准储备液的配制。称取色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺标准品适量,用0.1mol/LHCl配制成质量浓度各为1mg/mL的标准储备液,置于-20℃冰箱储存备用,保存期为4个月。1.2.1.2混合标准系列溶液的配制。临用前配制。取“1.2.1.1”储备液1mL,用0.1mol/LHCl稀释至100mL,得到10μg/mL的中间液,取标准品储备液0、10、50、100、500、1000、2000μL用0.1mol/LHCl定容至10mL,得到浓度为0、0.01、0.05、0.10、0.50、1.00、2.00μg/mL的混合标准溶液。.
1.2.2样品制备。
1.2.2.1样品提取。准确称取5.0g代表性均质化样品置于50mL离心管中,加入15mL5%三氯乙酸溶液,涡旋1min,超声10min,10℃下8000r/min离心5min,上清液转移至50mL离心管中。残渣中加入10mL5%三氯乙酸溶液,涡旋1min,超声10min,10℃下8000r/min离心5min,合并上清液于上述离心管,待净化。
1.2.2.2样品净化。向上述试样提取液中加入20mL正己烷,涡旋振荡5min,10℃下8000r/min离心5min,弃去上层有机相,下层试样溶液加入20mL正己烷再除脂一次,下层试样溶液转移至25mL容量瓶用5%三氯乙酸溶液定容至刻度,待衍生。
1.2.2.3样品衍生。分别移取上述提取液和生物胺标准系列溶液各0.1mL,置于2mL离心管中,依次加入100μL饱和碳酸氢钠溶液、20μL1mol/L氢氧化钠溶液和0.1mL丹酰氯溶液(10mg溶于1mL丙酮溶液),盖塞封口,60℃避光反应25min。反应完毕后,加入10μL氨水,60℃避光反应15min终止反应,氮气吹干后用乙腈定容至1mL,过0.2μm聚丙烯滤膜(GHP)滤膜后,待液质联用仪测定。
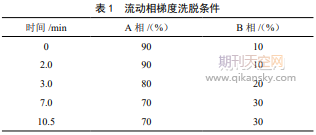
1.2.3色谱条件。色谱柱为WatersACQUITYUPLCBEHShieldRP18柱(2.1mm×150mm,1.7μm);流动相A相为含0.1%甲酸的50%乙腈水溶液,B相为乙腈;柱温30℃;流速0.3mL/min,进样量5μL;流动相梯度见表1。
1.2.4质谱条件。扫描方式为电喷雾正离子(ESI+)扫描;检测方式为多反应监测(MRM);毛细管电压3.0kV;离子源温度120℃;脱溶剂气流量1000L/h,脱溶剂气温度500℃,锥形气体流速150L/h。质谱检测参数见表2。
2结果与分析
2.1不确定度的识别和来源依据测定步骤,对三文鱼中生物胺测定结果的不确定度的来源分析见图1。
2.2不确定度的分析
2.2.1被测定物质量浓度u(C)。标准储备液的配制、稀释以及标准曲线的线性拟合是影响被测定物质量浓度(C)带来的不确定度的主要过程。
3结论
该试验评价了三文鱼中生物胺的液相色谱-串联质谱法的不确定度,色胺、β-苯乙胺、腐胺、尸胺、酪胺、组胺、精胺、亚精胺、去甲基肾上腺素的含量分别为4.30±0.46、5.59±0.56、5.72±0.48、6.21±0.54、4.85±0.42、5.48±0.50、7.18±0.64、6.79±0.55、4.77±0.41mg/kg。结果表明,试验操作步骤中会多方引入不确定度,分析发现标准储备液的配制、稀释以及标准曲线的线性拟合对不确定度的贡献值最大,回收率次之。在试验过程中,操作人员熟练水平的提升、仪器的及时维护、平行样本测定次数的增加等方法可减小测量结果的不确定度。——论文作者:郑越男1,曹进2*,孙珊珊2,郭亚辉1,罗娇依2,钱和1
* 稍后学术顾问联系您