摘要:目的建立聚丙烯药用滴眼剂瓶无菌检查方法。方法洗脱液为0.9%无菌氯化钠溶液,取样量参照《中国药典》四部通则<1101>医疗器械,瓶身中加入标示容量的0.9%无菌氯化钠溶液,旋紧外盖振摇30s,合并提取液后采用薄膜过滤法检查;内盖采用直接接种法检查。结果无菌检查前处理研究中低浓度人工污染的枯草芽胞杆菌、大肠埃希菌、金黄色葡萄球菌、黑曲霉和白色念珠菌的回收率均符合《中国药典》要求;方法适用性实验中试验菌生长均良好。结论本法取样量和样品前处理方法科学有效,适用于聚丙烯药用滴眼剂瓶的无菌检查。
关键词:聚丙烯滴眼剂瓶;直接接种法;薄膜过滤法;无菌检查
聚丙烯滴眼剂瓶是目前国内常用的滴眼剂包装形式[1],这种塑料包装材料在高温下易变形,因此采用本材料包装的无菌滴眼剂需采用非终端灭菌的无菌生产工艺进行无菌灌装。聚丙烯滴眼剂瓶应在无菌灌装前进行灭菌确保其无菌。药品包装材料的微生物污染风险直接影响药品质量[2-7],尤其是非终端灭菌无菌制剂的药品包装材料,为确保此类药品的质量安全,必须严格控制包装材料的微生物污染。2010年版《中华人民共和国药典》(以下简称《中国药典》)中滴眼剂增加了无菌检查,滴眼剂按无菌制剂进行生产,但现行《国家药包材标准》仅规定创伤或手术滴眼剂瓶进行无菌检查,与目前相关标准规定不符。且《国家药包材标准》中无菌检查仅简单规定检查方法,参照《中国药典》无菌检查法,导致聚丙烯滴眼剂瓶无菌检查在实际操作中遇到如取样量代表性等问题,且未按《中国药典》要求进行方法适用性试验,因此样品前处理方法和无菌检查方法的选择等方面皆有待改善。由于聚丙烯滴眼剂瓶包含瓶身、外盖及内盖,包装形式相互独立,本实验分别以滴眼剂瓶瓶身、外盖和内盖为对象进行无菌检查方法的研究,通过取样量、样品前处理方法和无菌检查方法适用性等研究,对本品的无菌检查方法进行全面改善,提高聚丙烯滴眼剂瓶无菌检查的操作性、适用性及使用安全性。
1材料与方法
1.1材料聚丙烯药用滴眼剂瓶(规格:5ml,批号:171206;规格:8ml,批号:171220;规格:10ml,批号:161129)均由慈溪市观城塑料包装容器厂提供。
1.2仪器与试剂HTY-2000B型集菌仪(中国杭州泰林生物技术股份有限公司);FC502一次性使用集菌培养器(中国杭州泰林生物技术股份有限公司)。硫乙醇酸盐流体培养基(FTM,批号:20190110)、胰酪大豆胨琼脂培养基(TSA,批号:20180623)、沙氏葡萄糖琼脂培养基(SDA,批号:20191010)、沙氏葡萄糖液体培养基(SDB,批号:20181223)和胰酪大豆胨液体培养基(TSB,批号:20190511)均由中国青岛海博科技有限公司提供,以上培养基适用性检查均符合中国药典2015年版规定[8]。标准菌株和定量菌球:枯草芽胞杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(F)44102]、生孢梭菌[CMCC(B)64941]、白色念珠菌[CMCC(F)98001]和黑曲霉[CMCC(F)98003]由中国药品生物制品检定所提供。BioballMultishot550金黄色葡萄球菌、BioballMultishot550大肠埃希菌、BioballMultishot550枯草芽胞杆菌、BioballMultishot550白色假丝酵母和BioballMultishot550黑曲霉定量菌球均由法国梅里埃公司提供。
1.3方法
1.3.1菌液制备接种金黄色葡萄球菌和大肠埃希菌至TSB中,33℃培养18h;接种枯草芽胞杆菌至TSA斜面,33℃培养18h;接种生孢梭菌至FTM中,33℃培养18h;接种白色念珠菌至SDB中,23℃培养2d;接种黑曲霉至SDA斜面,23℃培养7d。每种菌的新鲜培养物按要求稀释制备菌悬液,分别计数,不同菌悬液每毫升含菌数均不大于100cfu。5种定量菌球均按使用说明书分别复溶至每毫升含菌约500cfu,取菌悬液各0.1ml分别计数。
1.3.2瓶身和外盖无菌检查前处理研究取3批已灭菌(规格:5ml、8ml和10ml)的聚丙烯药用滴眼剂瓶,每批产品取25个样品作为供试品,每种规格的供试品均进行低浓度人工污染金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、白色假丝酵母和黑曲霉。每种菌的接种同法操作5次,方法如下:将枯草芽胞杆菌定量菌球溶液0.1ml均匀滴洒至瓶内壁,旋上外盖置50℃烘箱晾干;将大肠埃希菌、金黄色葡萄球菌、黑曲霉和白色假丝酵母的定量菌球溶液各取0.1ml分别均匀滴洒至瓶内壁,之后轻旋上外盖。
相关知识推荐:卫生系统晋职称论文发表指导
取供试品标示容量的洗脱液(0.9%无菌氯化钠溶液)缓慢注入已接种的样品中,旋紧外盖振荡30s,将洗脱液薄膜过滤后取滤膜培养,作为试验组。取未接种菌的样品同法操作为供试品对照组。同时取上述5种菌的菌悬液各0.1ml分别计数作为菌液组。细菌接种至TSA平板于33℃培养3d,霉菌和酵母菌接种至SDA平板于23℃培养5d。
1.3.3瓶身和外盖无菌检查方法适用性试验试验组:取上述三批聚丙烯药用滴眼剂瓶的瓶身和外盖,每批样品取120瓶,20瓶一组分成6组。每瓶中加入标示容量的0.9%无菌氯化钠溶液,旋紧外盖振荡30s,合并20瓶的提取液,在提取液中加入“1.3.1”项制备的菌悬液1ml。按照《中国药典》无菌检查方法适用性试验要求,6组提取液分别加入金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、生孢梭菌、白色念珠菌和黑曲霉。将提取液薄膜过滤后再加FTM或TSB至滤筒中。将上述滤筒分别置规定温度培养5d,观察结果。对照组:另取装有同体积培养基的滤筒,分别加入等量不同试验菌。同试验组培养,观察结果。
1.3.4内盖无菌检查方法适用性试验试验组:取上述三批聚丙烯药用滴眼剂瓶的内盖,每批样品取120个,20个一组分成6组。将20个内盖放入同一无菌瓶中,再加入FTM或TSB,并加入“1.3.1”项制备的菌悬液1ml。按照《中国药典》无菌检查方法适用性试验要求,6组提取液分别加入金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、生孢梭菌、白色念珠菌和黑曲霉。将上述无菌瓶分别置规定温度培养5d,观察结果。对照组:另取装有同体积培养基的滤筒,分别加入等量不同试验菌。同试验组培养,观察结果。
2结果
2.1菌液计数结果取“1.3.1”项制备和稀释的菌液,按平皿法测定菌落数,每株试验菌平行制备2个平皿。金黄色葡萄球菌、大肠埃希菌、生孢梭菌、枯草芽胞杆菌、白色念珠菌和黑曲霉标准菌株的计数结果分别为42cfu/皿、42cfu/皿、33cfu/皿、19cfu/皿、28cfu/皿、62cfu/皿,金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、白色念珠菌和黑曲霉定量菌球的计数结果分别为47cfu/皿、47cfu/皿、48cfu/皿、44cfu/皿、52cfu/皿。
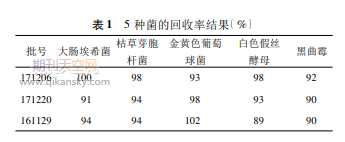
2.2瓶身和外盖无菌检查前处理研究结果试验组中的金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、白色假丝酵母和黑曲霉5种菌在不同规格样品中的回收率均>80%(表1),符合《中国药典》中“微生物回收”的要求,表明本品的无菌检查前处理可采用“1.3.2”项前处理方法。
2.3瓶身和外盖无菌检查方法适用性试验结果聚丙烯药用滴眼剂瓶瓶身和外盖的无菌检查适用性试验结果见表2。实验组中试验菌生长情况与对照管比较,结果均生长良好。表明本品瓶身和外盖无菌检查方法可以采用“1.3.2”项浸提法结合薄膜过滤法,且样品的检验量在本试验条件下无抑菌作用。
2.4内盖无菌检查方法适用性试验结果聚丙烯药用滴眼剂瓶内盖的无菌检查适用性试验结果见表3。实验组中试验菌生长情况与对照管比较,结果均生长良好。表明本品内盖的无菌检查方法可以采用直接接种法,且样品的检验量在本试验条件下无抑菌作用。
2.5聚丙烯药用滴眼剂瓶的无菌检查法根据上述试验结果,本品的取样量可参照《中国药典》四部通则(1101)医疗器械,内盖等量直接接种于各管适量培养基中,瓶身加入标示容量的0.9%无菌氯化钠溶液,将外盖旋紧,振摇30s,合并提取液,经薄膜过滤法处理,照无菌检查法(《中国药典》四部通则1101)检查,均应符合规定。
3讨论
2015年版《国家药包材标准》YBB00072002-2015中聚丙烯药用滴眼剂瓶无菌检查的取样量为11个,仍按照2002年-2004年颁布的药品包装材料标准中规定的取样量取样未进行修订。无菌检查取样量应考虑产品污染率和无菌检查“通过”率,现行《中国药典》无菌检查的取样量按照上述关系确定。当存在微生物污染时,取样量越大,无菌检查“通过”率就越低。鉴于取样的代表性及科学性,本品无菌检查的取样量可参照《中国药典》四部通则(1101)医疗器械,同时应考虑灭菌剂残留等因素可能会造成无菌检查的假阴性,应增加阳性对照的取样量。由于聚丙烯药用滴眼剂瓶批产量基本都在1000瓶以上,无菌检查取样量参照《中国药典》四部通则(1101)医疗器械,出厂检验中接种每种培养基至少20瓶,其出厂检验量应为60瓶,上市监督检验量应为30瓶。
国外药品包装材料的无菌检查方法主要也是参照医疗器械实施,产品性状允许的情况下,采用直接接种法,无法采用直接接种的样品选择浸提法结合薄膜过滤法[9-10],国内医疗器械的无菌检查也参照这个原则[11-15]。由于浸提法结合薄膜过滤法存在微生物转移损失和操作繁琐造成假阳性的风险,在药品包装材料性状允许的情况下,无菌检查方法应优先考虑直接接种法。聚丙烯药用滴眼剂瓶的组成包含瓶身、外盖和内盖,三部分包装相对独立。因构造和规格等原因,瓶身并不适用于直接接种法,需采用浸提法结合薄膜过滤法,而内盖则可以采用直接接种法。由于聚丙烯药用滴眼剂瓶的规格都相对较小,所以将洗脱液的量定为标示容量。无菌检查取样量参照《中国药典》医疗器械后取样量是之前的数倍,若振摇洗脱时间仍采用现行标准的1min,则60个瓶子需要振摇60min。无菌检查振摇洗脱时间较长,操作繁琐且容易造成污染,因此将每瓶的振摇时间定为30s,并进行低浓度人工污染金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌、白色念珠菌和黑曲霉5种代表性菌株的回收率的考察,5种菌分别代表革兰阳性菌、革兰阴性菌、芽胞菌、酵母和霉菌。样品前处理研究表明振摇时间30s时,每种菌的洗脱回收率均符合要求,因此可将洗脱液定为标示容量以及振摇洗脱时间定为30s。本品内盖相对独立,为减少滴眼剂瓶组装操作带来的污染风险,采用直接接种法进行内盖的无菌检查。无菌检查方法适用性试验结果证明本研究建立的无菌检查方法适用于聚丙烯药用滴眼剂瓶。——论文作者:周燕丽







