0
发表咨询在线!

摘要:兼具良好孔隙率和原位任意塑型固化的可注射复合多孔骨修复材料在临床不规则骨缺损的治疗方面显示出巨大的优势。本研究通过优化双组份设计,以水为发泡剂制备可注射纳米羟基磷灰石/聚氨酯(nHA/PU)复合多孔支架。利用扫描电子显微镜(SEM)、傅里叶变换红外光谱(FT-IR)、X射线衍射(XRD)、力学测试及吉尔摩针测试等手段对制备的支架进行结构形貌、化学组成、力学性能和固化时间表征。结果表明:本研究制备的可注射nHA/PU复合多孔支架孔隙率高、孔隙贯通性好,孔径分布在100~700μm,适宜细胞和组织向孔内生长;添加20%nHA显著提高了PU支架的力学强度,但降低了支架的孔隙率;可注射支架在8h固化,适宜临床操作。本研究制备的可注射nHA/PU复合多孔支架在不规则骨缺损修复领域具有较大的应用潜力。
关键词:纳米羟基磷灰石;聚氨酯;可注射;孔隙率;骨修复
大段骨缺损由于因人而异的不规则特性,仍是临床治疗面临的一大挑战[1-3]。近年来,可注射骨修复材料因具有任意塑型、原位固化、微创等诸多优点而备受关注[4-6]。以硫酸钙[7]、磷酸钙[8]、羟基磷灰石[9]等无机类及壳聚糖[10]、聚甲基丙烯酸甲酯[11]等高分子类为代表的可注射骨修复材料已取得了较好的进展,但在不同程度上存在孔隙率低、固化时间过长或力学性能较差等缺点,仍难以满足临床对高性能可注射骨修复材料的需求。
聚氨酯因具有良好的生物相容性、可降解性和结构可调控等优点,作为新型可注射材料的代表之一,已在生物医学领域引起广泛关注[12-14]。但其存在固化时间较长影响组织愈合、孔隙率较低阻碍细胞长入、生物活性较低等问题,临床应用受限。
纳米羟基磷灰石(nHA)因与骨矿物质组成相似、具有良好的生物相容性和骨传导性等优点已广泛应用于骨组织工程领域[15]。近年来已有研究报道成功制备了快速固化的可注射聚氨酯/羟基磷灰石根管充填材料,但缺少适宜成骨的孔隙结构[16]。聚氨酯预聚物中存在的异氰酸根(NCO)可与水反应生成CO2可使聚氨酯体系发泡成孔[17],本研究拟将水作为发泡剂加入聚氨酯反应体系,优化双组份设计[16,18],构建可注射nHA/PU复合多孔骨修复支架,以期赋予材料利于细胞黏附、增殖和物质运输的多孔结构,并对其结构及性能进行表征,探讨其作为可注射多孔骨修复支架的可行性。
1实验材料和方法
1.1材料
聚四氢呋喃醚二醇(PTMEG),分子量2000;异佛尔酮二异氰酸酯(IPDI);三乙醇胺;聚乙二醇(PEG),分子量600;1,4-丁二醇(BDO);2,2-双羟甲基丙酸(DMPA);二月桂酸二丁基锡;锌酸亚锡。以上试剂购自上海阿拉丁试剂公司,均为分析纯。纳米羟基磷灰石(nHA)参照文献方法由本实验室自制[19]。
1.2可注射聚氨酯多孔支架制备
组分A1:取PTMEG和IPDI(摩尔比NCO:OH=2:1)加入到三颈瓶中,70℃油浴反应5h后,加入适量的扩链剂BDO(质量为PTMEG的2.22%)反应2h,制得NCO封端的聚氨酯预聚体。整个反应过程使用氮气保护。
组分A2:取PTMEG和IPDI(摩尔比NCO:OH=2:1)加入到三颈瓶中,70℃油浴反应5h后,加入适量的扩链剂DMPA(质量为PTMEG的1.25%)反应2h,制得NCO封端的聚氨酯预聚体。整个反应过程使用氮气保护。
相关知识推荐:化工中级职称条件
组分B1(固化剂1):在室温下由二月桂酸二丁基锡、三乙醇胺、聚乙二醇600、水以质量比1:15:6:20均匀混合而成。
组分B2(固化剂2):在室温下由锌酸亚锡、三乙醇胺、聚乙二醇600、水以质量比3:17:45:60均匀混合而成。
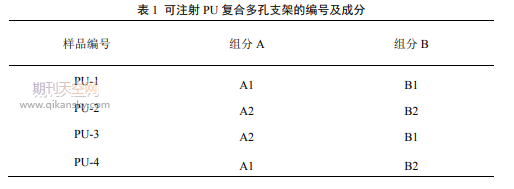
组分A和组分B分别按体积比50:1混合,充分搅拌30s后形成可注射聚氨酯基多孔材料,分别记为PU-1、PU-2、PU-3、PU-4,如表1所示。
1.3可注射纳米羟基磷灰石/聚氨酯复合多孔支架制备
在PU-3的基础上制备nHA/PU复合支架,在组分A2的制备中加入适量的扩链剂DMPA反应2h后,加入0%、10%和20%的nHA粉末继续搅拌2h,制得NCO封端的聚氨酯预聚体,分别记为Pre-PU0、Pre-PU10和Pre-PU20。整个反应过程使用氮气保护。含nHA0%、10%和20%的可注射nHA/PU基复合多孔支架分别记为PU0、PU10和PU20。
1.4测试与表征
采用扫描电子显微镜(SEM,JSM-6500LV,日本电子公司)观察多孔支架的形貌;傅里叶变换红外光谱仪(FT-IR,Nicolet-6700,美国Thermo公司)用于样品的官能团和化学键表征;采用X射线衍射仪(XRD,DX-2500,中国丹东方圆公司)分析多孔支架的物相组成和晶体结构;电子万能试验机(AGIC50,日本岛津公司)测定力学性能(测定方法参照GB/T1041—92,试验压头速度为0.5mm/min);同步热分析仪(STA,449F3,德国耐驰公司)用于热力学分析;采用水浸渍法[20]测定PU系列骨修复支架的孔隙率;用ImageJ分析软件统计支架的孔径分布;采用Gillmore双针法测定的可注射PU系列骨修复材料的初凝时间与终凝时间(测定方法参照GB/T1346)。
2实验结果与讨论
2.1可注射PU多孔支架的性能表征图1(a)、(b)、(e)、(f)分别为PU-1、PU-2、PU-3和PU-4多孔支架形貌图。从图1可以看出,PU-1、PU-3
多孔支架富含贯穿孔,且孔径主要分布在100~700μm[图1(c)、(g)]。PU-3较PU-1孔径分布更加均匀。PU-2、PU-4孔径分布相对均匀,但存在较多闭合孔,不利于细胞和组织长入。
图2为可注射PU系列骨修复材料的终凝时间。从图中可以看出,PU-2的终凝时间最短为(1±0.1)h,其次是PU-3,终凝时间为(5±0.4)h。两者的终凝时间显著低于PU-1、PU-4,表明以DMPA为扩链剂可以加速聚氨酯预聚物与固化剂反应,缩短固化时间。此外,PU-2与PU-3的固化时间均明显低于FDA批准的新型PU基生物材料(KryptoniteTM)24h的固化时间[14],可以更好地满足临床应用要求。其中PU-3固化时间较PU-2略长,但能获得较理想的孔隙结构,故优选PU-3支架进一步研究。
2.2可注射nHA/PU复合多孔支架的性能表征
nHA作为人骨主要的无机成分,具有良好的生物活性,是一种理想的骨修复材料[21]。在PU-3的基础上复合nHA制备出nHA/PU仿生复合多孔支架。从图3可以看出,PU0、PU10、PU20支架富含贯穿孔,孔形为球形或椭球形,孔径均匀分布在100~700μm,适合细胞的迁入和增殖[22]。添加nHA的复合多孔支架贯通性较好。随着nHA含量的增加,支架贯通性得到提高,有利于组织的长入及营养物的运输[23]。孔隙率测试结果显示(表2)未添加nHA的支架孔隙率高于添加nHA组15%以上,且随着nHA添加量的增加,制备的PU20复合支架孔隙率降低至57.8%±2.9%,依然可以满足细胞及组织的长入[19]。
图4为PU0、PU10、PU20支架的固化时间。从图4可以看出,PU0初凝时间和终凝时间最短,分别为3±0.2h和5±0.4h。PU20初凝时间和终凝时间最长,分别为(4.5±0.2)h和(8±0.4)h。PU的固化时间随nHA含量的增高而增加,主要是nHA的加入在一定程度上阻碍了聚合物链间的相互作用,从而减缓了聚合过程,加入nHA越多,对聚合反应的影响越显著。
图5为3种可注射PU基多孔支架和nHA的XRD图,PU是一种半结晶聚合物,其衍射峰主要出现在20°附近[24],nHA的添加降低了PU的结晶度,可能是由于高比表面积nHA纳米颗粒均匀地分散在聚氨酯基体中,于无机-有机界面处形成大量氢键使得聚氨酯交联过程中氢键化程度下降,限制了分子链段的运动,导致PU结晶度下降。此外,支架中nHA(对应PDF标准卡片#090432)峰强度随着nHA含量的增加而逐渐增强,主要在2θ=31.77°处最为显著。PU20支架的XRD谱图中出现较明显的nHA衍射峰,而PU10图谱中只观察到较弱的nHA衍射峰,主要是无机粒子被PU包覆,使其衍射峰强度减弱。
图6是添加不同比例nHA的PU预聚物和PU复合支架的红外光谱图。图6(A)显示随着nHA的掺加量增多,2256cm-1附近存在—NCO的伸缩振动峰值明显减弱,验证了聚合反应受nHA影响较大。因此,在PU10与PU20制备过程中增加25%IPDI,以减弱nHA对聚合反应的影响。图6(B)显示,3330cm-1处的宽峰为硬段N—H的伸缩振动峰、2854cm-1处的吸收峰则是亚甲基的对称伸缩振动峰、1717cm-1附近的吸收峰为氢键化的酰胺碳基伸缩振动峰、1540cm-1左右的峰属于C—N伸缩振动峰和N—H弯曲振动峰的叠加、1238cm-1附近的吸收峰则是酰胺Ⅲ的振动吸收峰、1103cm-1左右的峰可能是C—O伸缩振动峰或者C—N伸缩振动峰。这些吸收峰的出现表明生成了氨基甲酸酯交联键。且PU在2854cm-1、2797cm-1、1717cm-1、1238cm-1、1103cm-1等处的吸收峰随着nHA的增加而减弱,表明PU的聚合程度随着nHA的增多而降低。2256cm-1处—NCO的吸收峰随着nHA的掺加量增多而减弱至消失,表明添加nHA要消耗反应体系中部分—NCO,在掺加nHA的体系中适量增加IPDI能有效提高聚氨酯的聚合程度。
PU10和PU20支架的力学强度显著高于PU0支架(表2),如PU20的压缩强度约为PU0的3.9倍。掺加nHA显著增强支架的力学性能,这主要是由于nHA的高比表面积与表面活性,促进了无机/有机两相的界面结合。同时,nHA纳米颗粒的均匀分布,分散了负荷,推动应力从聚氨酯大分子转移到无机纳米粒子,延缓了断裂,从而增大了压缩强度。因此nHA在一定程度上掺加越多,支架的强度增加越显著。
图7显示,3种支架的TG曲线均出现了两个明显的失重阶段,第一失重阶段为PU硬段降解,第二阶段对应PU软段降解[25]。根据TG曲线,以失重5%对应温度为支架的初始分解温度来考察支架的热稳定性,结果如表3所示。与PU0支架相比,PU10、PU20复合支架的初始分解温度分别高出4.2℃、4.9℃,表明掺加一定量的nHA提高了复合支架的热稳定性。主要是均匀分散的nHA与PU机体中的氨基甲酸酯基团形成较多的氢键,增强了材料中硬段微区的凝聚力,进而提高了支架中PU的交联程度。三者残余质量分别为0.15%、9.8%、19.8%,与无机添加物的比例基本保持一致。——论文作者:李根1,2,李吉东2
* 稍后学术顾问联系您